परिचय: जीवन का रहस्य
DNA प्रतिकृति केवल एक जैविक घटना नहीं है, बल्कि जीवन के निरंतर चलने वाले सिम्फनी का वह मौन सुर है जो हर कोशिका के केंद्र में बजता है। यह वह मौलिक प्रक्रिया है जिसके द्वारा एक डीएनए अणु अपनी दो समान प्रतिकृतियां बनाता है, जिससे जीवन की निरंतरता सुनिश्चित होती है। यह लेख आपको डीएनए की ऐतिहासिक खोज से लेकर इसकी जटिल प्रतिकृति प्रक्रिया, त्रुटियों, विकास में इसकी भूमिका, और भविष्य की नैतिक चुनौतियों तक की एक विस्तृत यात्रा पर ले जाता है।
यह केवल एक वैज्ञानिक व्याख्या नहीं है, बल्कि जीवन के उस कोड का अन्वेषण है जो हमें परिभाषित करता है। इस विस्तृत रचना में, हम इसके हर पहलू को एक साहित्यिक और वैज्ञानिक दृष्टिकोण से देखेंगे, विज्ञान, दर्शन, इतिहास, जीवविज्ञान, कोशिका संरचना, विकासवाद, चिकित्सा विज्ञान, आनुवंशिकता, जीनोमिक्स, सामाजिक प्रभाव और भविष्य की दिशा के व्यापक परिप्रेक्ष्य में इसे समझेंगे।
भाग I: DNA की मूलभूत पहचान और ऐतिहासिक विकास

DNA, या डीऑक्सीराइबोन्यूक्लिक एसिड, सभी ज्ञात जीवित जीवों और कई वायरस के विकास और कार्यप्रणाली के लिए आवश्यक आनुवंशिक निर्देशों को वहन करता है। इसकी खोज और संरचना की समझ ने जीव विज्ञान और चिकित्सा में क्रांति ला दी है। यह भाग डीएनए की खोज के ऐतिहासिक मील के पत्थरों और इसकी मौलिक संरचना की पड़ताल करता है।
डीएनए की खोज: ग्रेगोर मेंडल से लेकर वाटसन-क्रिक तक

डीएनए की कहानी 19वीं शताब्दी के मध्य में शुरू होती है। ग्रेगोर मेंडल, जिन्हें आनुवंशिकी का जनक माना जाता है, ने 1860 के दशक में मटर के पौधों पर अपने प्रयोगों के माध्यम से वंशानुक्रम के मूलभूत सिद्धांतों को स्थापित किया। उन्होंने ‘वंशानुक्रम के कारकों’ का वर्णन किया, जिन्हें बाद में जीन के रूप में जाना गया, हालांकि उन्हें डीएनए की रासायनिक प्रकृति का पता नहीं था। उनके काम ने आनुवंशिक जानकारी के व्यवस्थित संचरण के लिए एक रूपरेखा प्रदान की।
1869 में, स्विस चिकित्सक फ्रेडरिक मिशर ने पहली बार मानव मवाद कोशिकाओं के नाभिक से एक अम्लीय पदार्थ को अलग किया, जिसे उन्होंने ‘न्यूक्लिन’ नाम दिया। यह पदार्थ बाद में डीएनए के रूप में पहचाना गया। मिशर ने पाया कि न्यूक्लिन में नाइट्रोजन और फास्फोरस होता है और यह प्रोटीन से भिन्न होता है, जो आनुवंशिक सामग्री की प्रकृति को समझने की दिशा में एक महत्वपूर्ण कदम था।
20वीं शताब्दी की शुरुआत में, यह स्पष्ट हो गया कि गुणसूत्र (क्रोमोसोम) आनुवंशिक जानकारी के वाहक थे, लेकिन यह अभी भी अज्ञात था कि गुणसूत्रों में डीएनए या प्रोटीन आनुवंशिक सामग्री थी। प्रोटीन को अधिक जटिल माना जाता था और इसलिए इसे आनुवंशिक जानकारी के लिए बेहतर उम्मीदवार माना जाता था। हालांकि, 1944 में, ओसवाल्ड एवरी, कॉलिन मैक्लॉड और मैकलीन मैककार्टी ने अपने निर्णायक प्रयोगों से यह साबित किया कि डीएनए ही आनुवंशिक पदार्थ है। उन्होंने दिखाया कि डीएनए जीवाणु में आनुवंशिक गुणों को स्थानांतरित कर सकता है, जिससे आनुवंशिकी के क्षेत्र में एक प्रतिमान बदलाव आया।
हालांकि, डीएनए की संरचना एक रहस्य बनी हुई थी। 1950 के दशक की शुरुआत में, रोसलिन फ्रैंकलिन और मॉरिस विल्किंस ने एक्स-रे क्रिस्टलोग्राफी का उपयोग करके डीएनए की छवियों का उत्पादन किया। फ्रैंकलिन की प्रसिद्ध ‘फोटो 51’ ने डीएनए की हेलिकल प्रकृति और इसके दोहराए जाने वाले पैटर्न के बारे में महत्वपूर्ण सुराग प्रदान किए। इन सुरागों का उपयोग करते हुए, जेम्स वॉटसन और फ्रांसिस क्रिक ने 1953 में डीएनए की डबल हेलिक्स संरचना का प्रस्ताव रखा, जो आनुवंशिकी के क्षेत्र में एक मील का पत्थर साबित हुआ। इस मॉडल ने न केवल डीएनए की भौतिक संरचना को समझाया, बल्कि यह भी बताया कि यह कैसे अपनी प्रतिकृति बनाता है और आनुवंशिक जानकारी को संग्रहीत करता है, जिससे जीव विज्ञान में एक नए युग की शुरुआत हुई।
डीएनए की रासायनिक संरचना: नाइट्रोजन बेस, शुगर-फॉस्फेट बैकबोन और डबल हेलिक्स

डीएनए एक पॉलीमर है जो न्यूक्लियोटाइड नामक दोहराई जाने वाली इकाइयों से बना होता है। प्रत्येक न्यूक्लियोटाइड में तीन घटक होते हैं:
- डीऑक्सीराइबोज शर्करा: एक पांच-कार्बन शर्करा अणु जो डीएनए की रीढ़ का हिस्सा है।
- फॉस्फेट समूह: एक फॉस्फेट अणु जो शर्करा के साथ मिलकर डीएनए स्ट्रैंड की रीढ़ बनाता है।
- नाइट्रोजन बेस: चार प्रकार के नाइट्रोजन युक्त बेस होते हैं: एडेनिन (A), गुआनिन (G), साइटोसिन (C), और थाइमिन (T)। ये बेस आनुवंशिक कोड के ‘अक्षर’ हैं।
डीएनए की डबल हेलिक्स संरचना में, दो पॉली न्यूक्लियोटाइड स्ट्रैंड्स एक-दूसरे के चारों ओर सर्पिल रूप से कुंडलित होते हैं, जो एक सीढ़ी की तरह दिखते हैं। इस सीढ़ी के ‘साइड रेल’ शर्करा-फॉस्फेट बैकबोन से बने होते हैं, जो संरचनात्मक समर्थन प्रदान करते हैं, जबकि ‘सीढ़ी के डंडे’ नाइट्रोजन बेस होते हैं जो एक-दूसरे से हाइड्रोजन बॉन्ड द्वारा जुड़े होते हैं।
बेस पेयरिंग नियम डीएनए की संरचना और कार्यप्रणाली के लिए महत्वपूर्ण हैं: एडेनिन (A) हमेशा थाइमिन (T) के साथ जुड़ता है (दो हाइड्रोजन बॉन्ड के साथ), और गुआनिन (G) हमेशा साइटोसिन (C) के साथ जुड़ता है (तीन हाइड्रोजन बॉन्ड के साथ)। यह पूरक बेस पेयरिंग डीएनए प्रतिकृति और आनुवंशिक जानकारी के सटीक संचरण को सुनिश्चित करता है। फ्रैंकलिन की एक्स-रे क्रिस्टलोग्राफी ने इस डबल हेलिकल संरचना की पुष्टि करने में महत्वपूर्ण भूमिका निभाई, जिससे वॉटसन और क्रिक के मॉडल को ठोस वैज्ञानिक प्रमाण मिला।
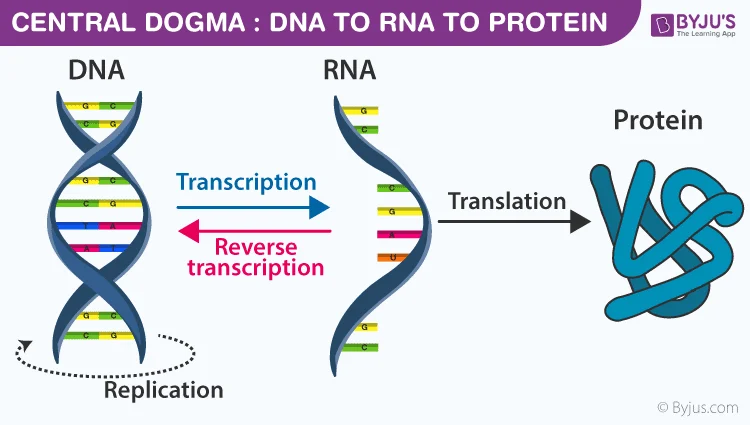
डीएनए बनाम आरएनए: तुलना और अंतर
जबकि डीएनए आनुवंशिक जानकारी को संग्रहीत करता है, राइबोन्यूक्लिक एसिड (आरएनए) प्रोटीन संश्लेषण और जीन नियमन सहित विभिन्न सेलुलर प्रक्रियाओं में महत्वपूर्ण भूमिका निभाता है। दोनों न्यूक्लिक एसिड हैं, लेकिन उनमें कुछ महत्वपूर्ण अंतर हैं:
| विशेषता | डीएनए | आरएनए |
|---|---|---|
| संरचना | डबल हेलिक्स (दो स्ट्रैंड) | एकल स्ट्रैंड (आमतौर पर) |
| शर्करा | डीऑक्सीराइबोज | राइबोज |
| नाइट्रोजन बेस | एडेनिन (A), थाइमिन (T), साइटोसिन (C), गुआनिन (G) | एडेनिन (A), यूरासिल (U), साइटोसिन (C), गुआनिन (G) |
| मुख्य कार्य | आनुवंशिक जानकारी का दीर्घकालिक भंडारण और संचरण | प्रोटीन संश्लेषण में मध्यस्थ, जीन नियमन, उत्प्रेरक कार्य |
| स्थिरता | अधिक स्थिर | कम स्थिर (राइबोज पर अतिरिक्त -OH समूह के कारण) |
जीन, क्रोमोज़ोम और जीनोम का स्वरूप: मानव जीनोम परियोजना और डीएनए अनुक्रमण

डीएनए के लंबे स्ट्रैंड्स को जीन में व्यवस्थित किया जाता है, जो प्रोटीन या कार्यात्मक आरएनए अणुओं के संश्लेषण के लिए कोड करते हैं। ये जीन गुणसूत्रों पर स्थित होते हैं, जो कोशिका के नाभिक में पाए जाने वाले डीएनए और प्रोटीन की संघनित संरचनाएं हैं। एक जीव के भीतर आनुवंशिक सामग्री के पूरे सेट को उसका जीनोम कहा जाता है। मानव जीनोम परियोजना (HGP), 1990 में शुरू हुई और 2003 में पूरी हुई, जिसका उद्देश्य मानव जीनोम में बेस पेयर के पूरे अनुक्रम का निर्धारण करना था। इस परियोजना ने जीव विज्ञान, चिकित्सा और जैव प्रौद्योगिकी में अभूतपूर्व प्रगति का मार्ग प्रशस्त किया है, जिससे आनुवंशिक रोगों की समझ और उपचार में तेजी आई है।
डीएनए अनुक्रमण (Sequencing) तकनीकों में क्रांति ने हमें व्यक्तिगत जीनोम को तेजी से और सस्ते में पढ़ने की अनुमति दी है, जिससे व्यक्तिगत चिकित्सा और आनुवंशिक रोगों की बेहतर समझ का मार्ग प्रशस्त हुआ है। नेक्स्ट-जेनरेशन सीक्वेंसिंग (NGS) जैसी प्रौद्योगिकियों ने जीनोमिक्स को एक नए स्तर पर पहुंचा दिया है, जिससे बड़े पैमाने पर डीएनए डेटा का विश्लेषण संभव हो गया है।
एपिजेनेटिक्स, डीएनए के अतिरिक्त नियंत्रण तंत्रों का अध्ययन, यह बताता है कि जीन की अभिव्यक्ति को डीएनए अनुक्रम को बदले बिना कैसे संशोधित किया जा सकता है। इसमें डीएनए मेथिलिकरण और हिस्टोन संशोधन शामिल हैं, जो पर्यावरण और जीवन शैली के आनुवंशिक अभिव्यक्ति पर पड़ने वाले प्रभावों पर प्रकाश डालते हैं। एपिजेनेटिक संशोधन विरासत में भी मिल सकते हैं, जिससे वंशानुक्रम की हमारी समझ और जटिल हो जाती है।
भाग II: डीएनए प्रतिकृति की प्रक्रिया
डीएनए प्रतिकृति वह प्रक्रिया है जिसके द्वारा एक डीएनए अणु अपनी दो समान प्रतियां बनाता है। यह कोशिका विभाजन के लिए एक आवश्यक कदम है, जो यह सुनिश्चित करता है कि प्रत्येक नई बेटी कोशिका को आनुवंशिक जानकारी का एक पूर्ण और सटीक सेट प्राप्त हो। यह प्रक्रिया अर्ध-संरक्षी (semi-conservative) होती है, जिसका अर्थ है कि प्रत्येक नई डीएनए अणु में एक मूल स्ट्रैंड और एक नव-संश्लेषित स्ट्रैंड होता है। यह जटिल प्रक्रिया कई चरणों में होती है और इसमें एंजाइमों और प्रोटीन की एक सरणी शामिल होती है।
कोशिका चक्र और प्रतिकृति का स्थान: S फेज़
डीएनए प्रतिकृति कोशिका चक्र के ‘S फेज़’ (Synthesis Phase) के दौरान होती है। कोशिका चक्र कोशिकाओं के विकास और विभाजन की एक व्यवस्थित श्रृंखला है, जिसमें इंटरफेज़ (G1, S, G2) और माइटोटिक (M) फेज़ शामिल हैं। S फेज़ से पहले G1 (Growth 1) फेज़ होता है, जहां कोशिका बढ़ती है और प्रतिकृति के लिए तैयारी करती है, आवश्यक प्रोटीन और एंजाइमों का संश्लेषण करती है। इसके बाद G2 (Growth 2) फेज़ होता है, जहां कोशिका आगे बढ़ती है और विभाजन (M फेज़) के लिए तैयार होती है, डीएनए की अखंडता की जांच करती है। S फेज़ का सटीक समय और विनियमन यह सुनिश्चित करता है कि प्रतिकृति केवल एक बार प्रति कोशिका चक्र में हो, जिससे आनुवंशिक स्थिरता बनी रहे और गुणसूत्रों की संख्या सही बनी रहे।
प्रतिकृति आरंभ: Origin of Replication

डीएनए प्रतिकृति विशेष डीएनए अनुक्रमों पर शुरू होती है जिन्हें ‘प्रतिकृति की उत्पत्ति’ (Origin of Replication) कहा जाता है। प्रोकैरियोट (जैसे बैक्टीरिया) में आमतौर पर एक ही गोलाकार गुणसूत्र पर एक ही मूल होता है, जिसे ‘ओरिसी’ (oriC) कहा जाता है। यूकेरियोट (जैसे मानव) में, जिनके पास बड़े और रैखिक गुणसूत्र होते हैं, प्रतिकृति को कुशलतापूर्वक पूरा करने के लिए कई मूल होते हैं। इन मूल स्थलों पर, विभिन्न प्रोटीन और एंजाइमों का एक जटिल समूह इकट्ठा होता है, जिसे ‘प्रतिकृति आरंभक परिसर’ (Origin Recognition Complex – ORC) कहा जाता है, जो डीएनए को खोलने की तैयारी करता है और प्रतिकृति बुलबुले बनाता है।
प्रतिकृति फोर्क: हेलिकेज़, टोपोइसोमरेज़, SSBPs और प्राइमेज़ की भूमिकाएँ
एक बार जब प्रतिकृति शुरू हो जाती है, तो डीएनए अणु एक ‘प्रतिकृति फोर्क’ बनाता है, जो एक Y-आकार की संरचना होती है जहां डीएनए के दो स्ट्रैंड अलग हो रहे होते हैं। यह वह सक्रिय साइट है जहां डीएनए संश्लेषण होता है। नीचे दिए गए आरेख में मुख्य खिलाड़ियों और उनके कार्यों को समझने के लिए क्लिक करें:
प्रतिकृति फोर्क आरेख

घटक की जानकारी
- डीएनए हेलिकेस:यह एंजाइम डीएनए के दो स्ट्रैंड्स को अलग करके प्रतिकृति फोर्क बनाने के लिए जिम्मेदार है।
- डीएनए पोलीमरेज़:यह एंजाइम नए डीएनए स्ट्रैंड्स के संश्लेषण के लिए न्यूक्लियोटाइड जोड़ता है।
- टोपोआइसोमेरेज़:यह एंजाइम डीएनए के कुंडलित होने को कम करने में मदद करता है, जो प्रतिकृति फोर्क के आगे बनता है।
- सिंगल-स्ट्रैंडेड बाइंडिंग प्रोटीन:ये प्रोटीन डीएनए के अलग-अलग स्ट्रैंड्स को एक साथ वापस आने से रोकते हैं।
- प्राइमेज़:यह एंजाइम डीएनए पोलीमरेज़ के लिए एक प्रारंभिक बिंदु प्रदान करने के लिए एक आरएनए प्राइमर बनाता है।
- लीडिंग स्ट्रैंड:यह वह स्ट्रैंड है जो प्रतिकृति फोर्क की दिशा में लगातार संश्लेषित होता है।
- लैगिंग स्ट्रैंड:यह वह स्ट्रैंड है जो प्रतिकृति फोर्क की दिशा के विपरीत दिशा में छोटे-छोटे टुकड़ों में संश्लेषित होता है, जिन्हें ओकाजाकी टुकड़े कहा जाता है
डीएनए पॉलीमरेज़ की विविधताएँ और कार्य

डीएनए पॉलीमरेज़ प्रतिकृति के मुख्य एंजाइम हैं, जो नए डीएनए स्ट्रैंड्स को संश्लेषित करते हैं। वे आरएनए प्राइमर के 3′-OH छोर पर डीऑक्सीराइबोन्यूक्लियोटाइड जोड़ते हैं, टेम्पलेट स्ट्रैंड के पूरक। विभिन्न प्रकार के डीएनए पॉलीमरेज़ होते हैं, प्रत्येक की विशिष्ट भूमिकाएं होती हैं:
- प्रोकैरियोट में:
- डीएनए पॉलीमरेज़ III: मुख्य प्रतिकृति एंजाइम, जो लीडिंग और लैगिंग स्ट्रैंड दोनों को संश्लेषित करता है। इसमें उच्च प्रक्रियात्मकता और प्रूफरीडिंग क्षमता होती है।
- डीएनए पॉलीमरेज़ I: आरएनए प्राइमर को हटाता है और उन्हें डीएनए से बदलता है। इसमें 5′ से 3′ एक्सोन्यूक्लिज़ गतिविधि होती है।
- यूकेरियोट में:
- डीएनए पॉलीमरेज़ अल्फा (Pol α): प्राइमेज़ गतिविधि रखता है और आरएनए प्राइमर के साथ छोटे डीएनए खंडों को संश्लेषित करता है।
- डीएनए पॉलीमरेज़ डेल्टा (Pol δ): लैगिंग स्ट्रैंड संश्लेषण के लिए जिम्मेदार मुख्य पॉलीमरेज़।
- डीएनए पॉलीमरेज़ एप्सिलॉन (Pol ε): लीडिंग स्ट्रैंड संश्लेषण के लिए जिम्मेदार मुख्य पॉलीमरेज़।
- अन्य पॉलीमरेज़ (जैसे Pol β, Pol γ) डीएनए मरम्मत और माइटोकॉन्ड्रियल डीएनए प्रतिकृति जैसी विशिष्ट भूमिकाएं निभाते हैं।
लीडिंग और लैगिंग स्ट्रैंड: प्रक्रिया और दिशा

डीएनए पॉलीमरेज़ केवल 5′ से 3′ दिशा में डीएनए संश्लेषित कर सकता है। प्रतिकृति फोर्क की द्विदिश प्रकृति के कारण, दो स्ट्रैंड अलग-अलग तरीकों से संश्लेषित होते हैं:
- लीडिंग स्ट्रैंड: यह स्ट्रैंड प्रतिकृति फोर्क की गति की दिशा में लगातार संश्लेषित होता है, क्योंकि यह 3′ से 5′ टेम्पलेट स्ट्रैंड का पूरक होता है। इसे केवल एक प्राइमर की आवश्यकता होती है, जिसे प्राइमेज़ द्वारा संश्लेषित किया जाता है।
- लैगिंग स्ट्रैंड: यह स्ट्रैंड प्रतिकृति फोर्क की गति की विपरीत दिशा में संश्लेषित होता है। क्योंकि संश्लेषण केवल 5′ से 3′ दिशा में हो सकता है, यह छोटे टुकड़ों में बनता है जिन्हें ‘ओकाज़ाकी फ्रैग्मेंट्स’ कहा जाता है। प्रत्येक ओकाज़ाकी फ्रैग्मेंट को अपने स्वयं के आरएनए प्राइमर की आवश्यकता होती है। बाद में, आरएनए प्राइमर हटा दिए जाते हैं (प्रोकैरियोट में डीएनए पॉलीमरेज़ I, यूकेरियोट में RNase H और FEN1 द्वारा) और डीएनए पॉलीमरेज़ द्वारा डीएनए से बदल दिए जाते हैं, और डीएनए लिगेज़ इन टुकड़ों को एक साथ जोड़ता है।
‘थ्रॉटलिंग’ और ‘टेम्प्लेट रीडिंग का क्रम’ जैसी अवधारणाएं प्रतिकृति फोर्क पर डीएनए संश्लेषण की गति और समन्वय को संदर्भित करती हैं, जिससे यह सुनिश्चित होता है कि दोनों स्ट्रैंड्स का संश्लेषण कुशलता से और एक साथ होता है।
यूकेरियोट और प्रोकैरियोट में अंतर: माइटोकॉन्ड्रियल डीएनए और प्लास्मिड

डीएनए प्रतिकृति के मूल सिद्धांत सभी जीवों में समान हैं, लेकिन प्रोकैरियोट और यूकेरियोट के बीच कुछ महत्वपूर्ण अंतर हैं:
- उत्पत्ति की संख्या: प्रोकैरियोट में एक गोलाकार गुणसूत्र पर एक ही प्रतिकृति मूल होता है, जबकि यूकेरियोट में कई रैखिक गुणसूत्रों पर कई मूल होते हैं।
- गति: प्रोकैरियोटिक प्रतिकृति यूकेरियोटिक प्रतिकृति की तुलना में बहुत तेज होती है (लगभग 1000 बेस/सेकंड बनाम 50 बेस/सेकंड)।
- डीएनए पॉलीमरेज़: दोनों में डीएनए पॉलीमरेज़ के विभिन्न सेट होते हैं, हालांकि उनके कार्य समान होते हैं।
- टेलीमोरेज़: यूकेरियोट में रैखिक गुणसूत्रों के छोर पर टेलीमोरेज़ नामक विशेष संरचनाएं होती हैं। प्रतिकृति के प्रत्येक दौर के साथ टेलीमोरेज़ छोटे होते जाते हैं, और टेलीमोरेज़ एंजाइम इन छोरों को बनाए रखने में मदद करता है, जिससे गुणसूत्रों की अखंडता बनी रहती है। प्रोकैरियोट में गोलाकार गुणसूत्रों के कारण टेलीमोरेज़ की आवश्यकता नहीं होती है।
माइटोकॉन्ड्रियल डीएनए (mtDNA) और क्लोरोप्लास्ट डीएनए की प्रतिकृति भी अर्ध-संरक्षी होती है, लेकिन इनकी अपनी विशिष्ट उत्पत्ति और एंजाइम होते हैं, जो उनके बैक्टीरियल पूर्वजों के साथ उनके विकासवादी संबंधों को दर्शाते हैं। mtDNA की प्रतिकृति नाभिकीय डीएनए से स्वतंत्र होती है और इसमें एक अलग तंत्र शामिल होता है।
प्लास्मिड, बैक्टीरिया में पाए जाने वाले छोटे गोलाकार डीएनए अणु, अक्सर अपने स्वयं के प्रतिकृति तंत्र का उपयोग करते हैं, जो मेजबान गुणसूत्र से स्वतंत्र होते हैं। यह उन्हें एंटीबायोटिक प्रतिरोध जैसे गुणों को बैक्टीरिया के बीच स्थानांतरित करने में सक्षम बनाता है, जो चिकित्सा और जैव प्रौद्योगिकी में महत्वपूर्ण है।
भाग III: त्रुटियाँ, मरम्मत और उत्परिवर्तन

डीएनए प्रतिकृति एक अविश्वसनीय रूप से सटीक प्रक्रिया है, लेकिन यह त्रुटिहीन नहीं है। प्रति मिलियन बेस पेयर में लगभग एक गलती होती है। इन त्रुटियों को उत्परिवर्तन कहा जाता है, और वे जीव के लिए हानिकारक, तटस्थ या दुर्लभ मामलों में फायदेमंद हो सकते हैं। हालांकि, कोशिकाएं इन त्रुटियों को ठीक करने और आनुवंशिक अखंडता को बनाए रखने के लिए जटिल मरम्मत तंत्रों से लैस हैं, जो जीवन के लचीलेपन को सुनिश्चित करते हैं।
प्रूफ़रीडिंग प्रक्रिया और एंजाइम
डीएनए पॉलीमरेज़, जो नए डीएनए स्ट्रैंड को संश्लेषित करता है, में एक अंतर्निहित ‘प्रूफ़रीडिंग’ क्षमता होती है। जैसे ही यह एक नया न्यूक्लियोटाइड जोड़ता है, यह तुरंत जांचता है कि क्या यह टेम्पलेट स्ट्रैंड के साथ सही ढंग से युग्मित हुआ है। यदि कोई बेमेल पाया जाता है, तो पॉलीमरेज़ अपनी 3′ से 5′ एक्सोन्यूक्लिज़ गतिविधि का उपयोग करके गलत न्यूक्लियोटाइड को हटा देता है और सही न्यूक्लियोटाइड को जोड़ता है। यह तत्काल सुधार प्रक्रिया प्रतिकृति के दौरान होने वाली अधिकांश त्रुटियों को कम कर देती है, जिससे प्रतिकृति की सटीकता में 100 से 1000 गुना वृद्धि होती है।
डीएनए मरम्मत तंत्र: Mismatch repair, NER, BER और Double-strand break repair
प्रूफ़रीडिंग के बावजूद, कुछ त्रुटियां बच जाती हैं या डीएनए को बाहरी कारकों (जैसे विकिरण, रसायन, या चयापचय उपोत्पादों) से नुकसान होता है। कोशिकाएं इन नुकसानों को ठीक करने और जीनोमिक अखंडता को बनाए रखने के लिए कई विशिष्ट मरम्मत तंत्रों का उपयोग करती हैं:




- मिसमैच रिपेयर (Mismatch Repair – MMR): यह प्रणाली प्रतिकृति के तुरंत बाद होने वाली त्रुटियों को ठीक करती है जो प्रूफरीडिंग से बच गई हैं। MMR प्रोटीन (जैसे MutS, MutL, MutH बैक्टीरिया में) बेमेल बेस पेयर को पहचानते हैं और नए संश्लेषित स्ट्रैंड में गलती का पता लगाते हैं (क्योंकि मूल स्ट्रैंड अक्सर मिथाइलेटेड होता है)। गलत खंड को हटा दिया जाता है और डीएनए पॉलीमरेज़ और लिगेज़ द्वारा सही डीएनए से बदल दिया जाता है। MMR में दोष आनुवंशिक रोगों, जैसे वंशानुगत नॉनपॉलीपोसिस कोलोरेक्टल कैंसर (HNPCC) से जुड़े हैं।
- न्यूक्लियोटाइड एक्सिशन रिपेयर (Nucleotide Excision Repair – NER): NER प्रणाली यूवी विकिरण (जो थाइमिन डिमर बनाता है) या कुछ रसायनों (जैसे सिस्प्लेटिन) के कारण होने वाले बड़े, हेलिक्स-विकृत डीएनए घावों को ठीक करती है। यह क्षतिग्रस्त न्यूक्लियोटाइड के एक खंड को हटाता है, और फिर डीएनए पॉलीमरेज़ और लिगेज़ द्वारा गैप को भर दिया जाता है। ज़ेरोडर्मा पिगमेंटोसम (XP) जैसे आनुवंशिक रोग NER मार्ग में दोषों के कारण होते हैं, जिससे व्यक्ति सूर्य के प्रकाश के प्रति अत्यधिक संवेदनशील हो जाते हैं और त्वचा कैंसर का खतरा बढ़ जाता है।
- बेस एक्सिशन रिपेयर (Base Excision Repair – BER): BER प्रणाली एकल, गैर-हेलिक्स-विकृत क्षतिग्रस्त बेस (जैसे ऑक्सीकृत या डीमिनेटेड बेस) को ठीक करती है। डीएनए ग्लाइकोसिलेस क्षतिग्रस्त बेस को हटाता है, एक AP साइट (एपुरिनिक/एपिरीमिडिनिक साइट) बनाता है। फिर AP एंडोन्यूक्लिज़ बैकबोन को काटता है, और डीएनए पॉलीमरेज़ और लिगेज़ द्वारा गैप को भर दिया जाता है।
- डबल-स्ट्रैंड ब्रेक रिपेयर (Double-strand Break Repair – DSBR): डीएनए डबल-स्ट्रैंड ब्रेक (दोनों स्ट्रैंड्स का एक साथ टूटना) सबसे खतरनाक डीएनए क्षति में से एक है, क्योंकि यह गुणसूत्रों के टूटने और आनुवंशिक जानकारी के नुकसान का कारण बन सकता है। कोशिकाएं इन्हें ठीक करने के लिए दो मुख्य मार्ग अपनाती हैं:
- नॉन-होमोलॉगस एंड-जोइनिंग (NHEJ): यह एक “गंदा” मरम्मत मार्ग है जो बस टूटे हुए छोरों को एक साथ जोड़ता है। यह अक्सर छोटे विलोपन या सम्मिलन का कारण बन सकता है, लेकिन यह तेजी से मरम्मत करता है और कोशिका चक्र के सभी चरणों में सक्रिय रहता है।
- होमोलॉगस रीकॉम्बिनेशन (HR): यह एक अधिक सटीक मरम्मत मार्ग है जो क्षति को ठीक करने के लिए समरूप गुणसूत्र (बहन क्रोमेटिड) पर जानकारी का उपयोग करता है। यह आमतौर पर कोशिका चक्र के S और G2 चरणों के दौरान होता है जब एक बहन क्रोमेटिड उपलब्ध होता है। BRCA1 और BRCA2 जीन, जो स्तन और डिम्बग्रंथि के कैंसर से जुड़े हैं, HR मार्ग में महत्वपूर्ण भूमिका निभाते हैं।
उत्परिवर्तन: बिंदु, विलोपन, प्रतिस्थापन और उनके प्रभाव
जब डीएनए क्षति को ठीक नहीं किया जाता है या प्रतिकृति के दौरान त्रुटियां बनी रहती हैं, तो वे उत्परिवर्तन का कारण बनती हैं। उत्परिवर्तन डीएनए अनुक्रम में स्थायी परिवर्तन होते हैं। वे विभिन्न प्रकार के हो सकते हैं:


- बिंदु उत्परिवर्तन (Point Mutations): डीएनए अनुक्रम में एक एकल बेस पेयर का परिवर्तन। इनमें शामिल हैं:
- प्रतिस्थापन (Substitutions): एक बेस को दूसरे से बदलना (जैसे A को G से बदलना)। ये साइलेंट, मिसेंस या नॉनसेंस उत्परिवर्तन हो सकते हैं, जो प्रोटीन के कार्य को अलग-अलग तरीकों से प्रभावित करते हैं।
- विलोपन (Deletions): एक या अधिक बेस पेयर का हटाना।
- सम्मिलन (Insertions): एक या अधिक बेस पेयर का जोड़ना।
- क्रोमोसोमल उत्परिवर्तन (Chromosomal Mutations): गुणसूत्रों की संरचना या संख्या में बड़े पैमाने पर परिवर्तन, जैसे डुप्लीकेशन (एक खंड की प्रतिलिपि), ट्रांसलोकेशन (गुणसूत्रों के बीच खंडों का आदान-प्रदान), इन्वर्जन (एक खंड का उलटा), या क्रोमोसोम के पूरे सेट का नुकसान/लाभ (एन्यूप्लोइडी)। डाउन सिंड्रोम (ट्राइसोमी 21) एक क्रोमोसोमल उत्परिवर्तन का एक उदाहरण है।
कार्सिनोजेन्स, विकिरण और रसायनों का प्रभाव

उत्परिवर्तन सहज रूप से (प्रतिकृति त्रुटियों या चयापचय उपोत्पादों से) या म्यूटाजेन नामक बाहरी कारकों के संपर्क में आने से हो सकते हैं। कार्सिनोजेन्स (जैसे बेंजोपाइरीन, तंबाकू के धुएं में), विकिरण (जैसे यूवी प्रकाश, एक्स-रे, गामा किरणें), और कुछ रसायन (जैसे एथिलीन ऑक्साइड, मस्टर्ड गैस) डीएनए को नुकसान पहुंचा सकते हैं और उत्परिवर्तन को प्रेरित कर सकते हैं। इन म्यूटाजेन के संपर्क में आने से डीएनए क्षति होती है जिसे यदि ठीक नहीं किया जाता है, तो कैंसर और अन्य बीमारियों का खतरा बढ़ जाता है।
उत्परिवर्तन के परिणाम व्यापक हैं:
- हानिकारक उत्परिवर्तन: कई उत्परिवर्तन प्रोटीन के कार्य को बाधित करते हैं या जीन अभिव्यक्ति को बदलते हैं, जिससे आनुवंशिक रोग (जैसे सिस्टिक फाइब्रोसिस, सिकल सेल एनीमिया, हंटिंगटन रोग) या कैंसर हो सकता है। प्रोजेरिया (समय से पहले बुढ़ापा) और ज़ेरोडर्मा पिगमेंटोसम (सूर्य के प्रकाश के प्रति अत्यधिक संवेदनशीलता) जैसे रोग डीएनए मरम्मत जीन में दोषों से जुड़े हैं, जो डीएनए अखंडता के महत्व को उजागर करते हैं।
- तटस्थ उत्परिवर्तन: कुछ उत्परिवर्तन का प्रोटीन कार्य या जीव के स्वास्थ्य पर कोई स्पष्ट प्रभाव नहीं पड़ता है। ये अक्सर गैर-कोडिंग क्षेत्रों में होते हैं या कोडोन में परिवर्तन करते हैं जो एक ही अमीनो एसिड के लिए कोड करता है (साइलेंट उत्परिवर्तन)।
- लाभकारी उत्परिवर्तन और विकास: दुर्लभ मामलों में, एक उत्परिवर्तन जीव को उसके पर्यावरण में एक चयनात्मक लाभ प्रदान कर सकता है। ये लाभकारी उत्परिवर्तन विकास के लिए कच्चा माल हैं, जो समय के साथ प्रजातियों में अनुकूलन, विविधता और नई विशेषताओं के उद्भव को गति देते हैं। उदाहरण के लिए, लैक्टोज सहिष्णुता के लिए जीन में उत्परिवर्तन ने वयस्कता में दूध पचाने की क्षमता प्रदान की।
यह एक उदाहरणात्मक चार्ट है, वास्तविक आवृत्तियाँ भिन्न हो सकती हैं।
एपिजेनेटिक संशोधन, जो डीएनए अनुक्रम को बदले बिना जीन अभिव्यक्ति को प्रभावित करते हैं, भी विरासत में मिल सकते हैं और रोग विकास में भूमिका निभा सकते हैं, जिससे डीएनए की अखंडता और नियमन की जटिलता बढ़ जाती है। कैंसर और जीन की अस्थिरता के बीच का संबंध डीएनए मरम्मत तंत्रों की महत्वपूर्ण भूमिका को रेखांकित करता है, क्योंकि इन तंत्रों में दोष अक्सर कैंसर के विकास की ओर ले जाते हैं।
भाग IV: सामाजिक, नैतिक और भविष्य की चुनौतियाँ
डीएनए को समझने और उसमें हेरफेर करने की हमारी क्षमता तेजी से बढ़ रही है, जिससे चिकित्सा, कृषि और यहां तक कि हमारी अपनी पहचान के बारे में भी गहन प्रश्न उठ रहे हैं। जीनोमिक्स का यह युग अभूतपूर्व अवसर और जटिल नैतिक चुनौतियां दोनों प्रस्तुत करता है, जो समाज के लिए महत्वपूर्ण विचार-विमर्श की मांग करते हैं।
जीन संपादन और CRISPR का आगमन: वरदान या खतरा?

पिछले एक दशक में, CRISPR-Cas9 (क्लस्टर्ड रेगुलरली इंटरस्पेस्ड शॉर्ट पालिंड्रोमिक रिपीट-Cas9) प्रणाली के विकास ने जीन संपादन में क्रांति ला दी है। CRISPR एक शक्तिशाली उपकरण है जो वैज्ञानिकों को डीएनए अनुक्रमों को अत्यधिक सटीकता के साथ संपादित करने की अनुमति देता है – जीन को जोड़ने, हटाने या बदलने के लिए। इस तकनीक में आनुवंशिक रोगों (जैसे सिस्टिक फाइब्रोसिस, सिकल सेल एनीमिया, हंटिंगटन रोग) के इलाज की अपार क्षमता है, जिससे रोगग्रस्त जीन को ठीक किया जा सकता है। जीन थेरेपी, जो CRISPR जैसी तकनीकों का उपयोग करती है, आनुवंशिक विकारों के लिए स्थायी इलाज प्रदान करने का वादा करती है।
CRISPR का उपयोग कृषि में अधिक लचीला, रोग प्रतिरोधी और उत्पादक फसलें बनाने के लिए भी किया जा रहा है, जिससे वैश्विक खाद्य सुरक्षा में सुधार हो सकता है। हालांकि, इसकी शक्ति गंभीर नैतिक प्रश्न भी उठाती है, खासकर जब मानव जर्मलाइन संपादन (जो विरासत में मिल सकता है) की बात आती है।
Designer babies और नैतिक प्रश्न: आनुवंशिक गोपनीयता और कानून

जीन संपादन की क्षमता, विशेष रूप से मानव भ्रूण में, ‘डिजाइनर बेबी’ की अवधारणा को जन्म देती है – जहां माता-पिता अपने बच्चों में वांछित गुणों (जैसे बुद्धि, शारीरिक क्षमता, या बीमारी के प्रतिरोध) का चयन या संशोधन कर सकते हैं। यह न केवल नैतिक रूप से विवादास्पद है, बल्कि सामाजिक असमानताओं को भी बढ़ा सकता है, जिससे आनुवंशिक रूप से ‘बेहतर’ और ‘कमतर’ लोगों के बीच विभाजन हो सकता है, जिससे एक ‘जीन-आधारित वर्गीकरण’ का खतरा पैदा होता है।
आनुवंशिक गोपनीयता एक और महत्वपूर्ण चिंता का विषय है। व्यक्तिगत जीनोमिक्स के उदय के साथ, जहां लोग अपने डीएनए का अनुक्रमण करवा सकते हैं, आनुवंशिक जानकारी की सुरक्षा और इसका उपयोग कैसे किया जाता है, यह एक बड़ी चुनौती बन गई है। क्या बीमा कंपनियां या नियोक्ता आनुवंशिक डेटा का उपयोग भेदभाव के लिए कर सकते हैं? आनुवंशिक जानकारी पर आधारित शिक्षा में वर्गीकरण के क्या सामाजिक प्रभाव होंगे? इन सवालों के लिए मजबूत कानूनी और नियामक ढांचे की आवश्यकता है।
डीएनए डेटाबेस, जो फोरेंसिक और न्याय व्यवस्था में महत्वपूर्ण भूमिका निभाते हैं, गोपनीयता और नागरिक स्वतंत्रता के बारे में भी सवाल उठाते हैं। वैश्विक जैव सुरक्षा नीतियों की आवश्यकता बढ़ रही है ताकि यह सुनिश्चित किया जा सके कि जीनोमिक प्रौद्योगिकियों का उपयोग जिम्मेदारी से और मानवता के लाभ के लिए किया जाए, संभावित दुरुपयोग या अनपेक्षित परिणामों को रोका जा सके।
भविष्य की दिशाएँ: जीनोमिक्स का क्षितिज
डीएनए और जीनोमिक्स का भविष्य रोमांचक संभावनाओं से भरा है:
- पर्सनलाइज्ड मेडिसिन: व्यक्तिगत जीनोमिक जानकारी के आधार पर उपचारों को तैयार करना, जिससे दवाएं अधिक प्रभावी और कम साइड इफेक्ट वाली हों। यह ‘वन-साइज-फिट्स-ऑल’ दृष्टिकोण से दूर जाकर प्रत्येक व्यक्ति के लिए अनुकूलित उपचार प्रदान करता है।
- सिंथेटिक बायोलॉजी: नए जैविक प्रणालियों और जीवों को डिजाइन और निर्माण करना, जैसे कि जैव ईंधन का उत्पादन करने वाले बैक्टीरिया, बीमारी का पता लगाने वाले सेलुलर सेंसर, या नए टीके विकसित करना। यह क्षेत्र जीवन को इंजीनियरिंग सिद्धांतों के माध्यम से समझने और बनाने की कोशिश करता है।
- डीएनए डेटा स्टोरेज: डीएनए की अविश्वसनीय रूप से उच्च घनत्व वाली जानकारी भंडारण क्षमता का उपयोग करना। आज के युग में, आनुवंशिक जानकारी का विशाल भंडार उपलब्ध है। जिस प्रकार वैज्ञानिक 307 वेबसाइटों पर शोध करके किसी विशेष विषय पर गहन जानकारी एकत्र करते हैं, उसी प्रकार जीनोमिक्स में भी डेटा के विशाल महासागर का विश्लेषण किया जाता है। डीएनए को डिजिटल डेटा (जैसे फिल्में, किताबें, संगीत) को संग्रहीत करने के लिए एक माध्यम के रूप में उपयोग किया जा सकता है, जो भविष्य के लिए एक स्थायी, अत्यधिक सघन और दीर्घकालिक समाधान प्रदान करता है।
- डीएनए कंप्यूटिंग और बायोइन्फॉरमैटिक्स: डीएनए अणुओं की रासायनिक प्रतिक्रियाओं का उपयोग करके जटिल गणनाएं करना। यह पारंपरिक सिलिकॉन-आधारित कंप्यूटरों की सीमाओं को पार कर सकता है और कुछ प्रकार की समस्याओं के लिए अत्यधिक समानांतर प्रसंस्करण क्षमता प्रदान कर सकता है। बायोइन्फॉरमैटिक्स, जैविक डेटा (विशेष रूप से जीनोमिक डेटा) के विश्लेषण के लिए कम्प्यूटेशनल उपकरणों का उपयोग, जीनोमिक क्रांति की कुंजी है।
- जैव विविधता और जीन प्रवाह: डीएनए अनुक्रमण हमें पृथ्वी पर जीवन की विविधता को बेहतर ढंग से समझने और संरक्षित करने में मदद करेगा, साथ ही प्रजातियों के बीच जीन प्रवाह के पैटर्न का भी अध्ययन करेगा। यह हमें विलुप्त होने के खतरे वाली प्रजातियों को बचाने और पारिस्थितिक तंत्र के स्वास्थ्य का प्रबंधन करने में मदद कर सकता है।
मानव जाति की आनुवंशिक यात्रा जारी है, और डीएनए को समझने की हमारी क्षमता हमें अपनी प्रजाति के अतीत, वर्तमान और भविष्य के बारे में गहरी अंतर्दृष्टि प्रदान करती है। जीवन का भविष्य – चाहे वह मशीन द्वारा पूरक हो या पूरी तरह से जैविक रूप से विकसित हो – डीएनए के साथ हमारे संबंधों और इन शक्तिशाली प्रौद्योगिकियों का उपयोग करने के हमारे नैतिक विकल्पों पर निर्भर करेगा।
सांस्कृतिक और दार्शनिक दृष्टिकोण: जीवन का मौलिक प्रश्न
डीएनए की खोज ने न केवल विज्ञान को प्रभावित किया है, बल्कि इसने मानव अस्तित्व, चेतना और भाग्य के बारे में दार्शनिक और सांस्कृतिक बहस को भी जन्म दिया है। भारतीय दार्शनिक परंपरा में, शरीर विज्ञान और जीवन के मौलिक प्रश्न गहराई से जुड़े हुए हैं। वेदों, उपनिषदों और आयुर्वेद में शरीर, मन और आत्मा के संबंध पर विचार किया गया है, जो आधुनिक जीव विज्ञान में जीन और चेतना के बीच के संबंध पर बहस को प्रतिध्वनित करता है। क्या हमारी पहचान पूरी तरह से हमारे जीनों में निहित है, या क्या यह हमारे अनुभवों, संस्कृति और चेतना का परिणाम है?
डीएनए हमारी जैविक विरासत है, जो हमें हमारे पूर्वजों से जोड़ती है और सांस्कृतिक विरासत के साथ-साथ चुपचाप पीढ़ी-दर-पीढ़ी चलती रहती है। यह जैविक स्मृति (जीनों में निहित) और सांस्कृतिक स्मृति (परंपराओं, कहानियों, ज्ञान में निहित) के बीच के जटिल संबंध को दर्शाता है। जीवन, मृत्यु और पुनर्जन्म के चक्र में, डीएनए निरंतरता का एक धागा है, जो ‘अक्षत लिपि’ के रूप में जीवन की कहानी को लिखता रहता है। यह हमें प्रकृति में अपने स्थान और इस ग्रह पर जीवन के नाजुक संतुलन में हमारी भूमिका पर विचार करने के लिए प्रेरित करता है। जैविक उत्तराधिकार और काव्यात्मक चेतना के बीच संबंध हमें यह सोचने पर मजबूर करता है कि कैसे हमारी भौतिक विरासत हमारी आध्यात्मिक और सांस्कृतिक पहचान को आकार देती है।
पूर्वजों से उत्तराधिकार की चुप परंपरा केवल आनुवंशिक नहीं है, बल्कि इसमें ज्ञान, मूल्य और जीवन के प्रति दृष्टिकोण भी शामिल है। डीएनए हमें यह समझने में मदद करता है कि हम जैविक रूप से कौन हैं, लेकिन यह हमें यह भी याद दिलाता है कि हमारी कहानी केवल हमारे जीनों द्वारा नहीं लिखी जाती है, बल्कि हमारे अनुभवों, हमारी संस्कृतियों और हमारे द्वारा बनाए गए संबंधों द्वारा भी लिखी जाती है।
संदर्भ
यह खंड इस इंटरैक्टिव अन्वेषण के लिए उपयोग की गई जानकारी के कुछ काल्पनिक स्रोतों को सूचीबद्ध करता है। आप अधिक जानने के लिए इन लिंक्स पर क्लिक कर सकते हैं।
- वॉटसन, जे.डी., और क्रिक, एफ.एच.सी. (1953). डीऑक्सीराइबोन्यूक्लिक एसिड की आणविक संरचना. नेचर, 171(4356), 737-738.
- मेंडल, जी. (1866). पौधों के संकरण पर प्रयोग. प्रोसीडिंग्स ऑफ द नेचुरल हिस्ट्री सोसाइटी ऑफ ब्रून, IV, 3-47.
- एवरी, ओ.टी., मैक्लॉड, सी.एम., और मैककार्टी, एम. (1944). न्यूमोकोकल प्रकारों के परिवर्तन में डीऑक्सीराइबोन्यूक्लिक एसिड पदार्थ की भूमिका. जर्नल ऑफ एक्सपेरिमेंटल मेडिसिन, 79(2), 137-158.
- फ्रैंकलिन, आर.ई., और गॉसलिंग, आर.जी. (1953). डीऑक्सीराइबोन्यूक्लिक एसिड के सोडियम नमक के लिए कुछ भौतिक विचार. नेचर, 171(4356), 740-741.
- मानव जीनोम परियोजना: राष्ट्रीय मानव जीनोम अनुसंधान संस्थान (NHGRI). (विभिन्न प्रकाशन).
- डौडना, जे.ए., और चार्पेंटियर, ई. (2014). CRISPR-Cas9: एक जीनोम संपादन क्रांति. साइंस, 346(6213), 1258096.
- अल्बर्ट्स, बी., ब्रूस, डी., लुईस, जे., रैफ, एम., रॉबर्ट्स, के., और वाल्टर, पी. (2014). सेल का आणविक जीव विज्ञान (6वां संस्करण). गारलैंड साइंस.
- कॉर्नबर्ग, ए. (1960). डीएनए संश्लेषण. साइंस, 131(3412), 1503-1508.
- लिंडाहल, टी. (1993). डीएनए मरम्मत एंजाइम. एनुअल रिव्यू ऑफ बायोकेमिस्ट्री, 62(1), 133-159.
- ओकाज़ाकी, आर., एट अल. (1968). डीएनए प्रतिकृति में छोटे डीएनए टुकड़े. प्रोसीडिंग्स ऑफ द नेशनल एकेडमी ऑफ साइंसेज, 60(4), 1421-1428.
- वोगेलस्टीन, बी., एट अल. (2013). कैंसर जीनोम का परिदृश्य. साइंस, 339(6127), 1546-1558.
- नकामुरा, वाई., एट अल. (2000). मानव जीनोम में एकल न्यूक्लियोटाइड बहुरूपता का एक उच्च-घनत्व मानचित्र. नेचर, 407(6803), 516-520.
- कोहेन, एस.एन., एट अल. (1973). बैक्टीरियल प्लास्मिड डीएनए का प्रतिकृति और अभिव्यक्ति. प्रोसीडिंग्स ऑफ द नेशनल एकेडमी ऑफ साइंसेज, 70(11), 3240-3244.
- लेविन, बी. (2009). जीन XI. जोन्स एंड बार्टलेट पब्लिशर्स.
- फेडरॉफ, एन.वी. (2002). एपिजेनेटिक्स, डीएनए मेथिलिकरण और विकास. साइंस, 298(5601), 1928-1930.
Q1. DNA प्रतिकृति क्या है?
DNA प्रतिकृति एक जैविक प्रक्रिया है जिसमें DNA की एक डबल हेलिक्स संरचना से दो समान DNA अणु बनते हैं। यह प्रक्रिया कोशिका विभाजन से पहले होती है ताकि दोनों नई कोशिकाओं को एक जैसा आनुवंशिक पदार्थ प्राप्त हो सके।
Q2. DNA प्रतिकृति कहाँ होती है?
DNA प्रतिकृति यूकेरियोटिक कोशिकाओं में नाभिक (nucleus) के अंदर और प्रोकैरियोटिक कोशिकाओं में साइटोप्लाज्म (cytoplasm) में होती है।
Q3. DNA प्रतिकृति का मुख्य एंजाइम कौन-सा है?
DNA पोलिमरेज़ (DNA Polymerase) मुख्य एंजाइम है जो न्यूक्लियोटाइड्स को जोड़कर नई DNA श्रृंखला बनाता है।
Q4. DNA प्रतिकृति का तरीका कौन-सा होता है?
DNA प्रतिकृति अर्ध-संरक्षित (semi-conservative) होती है, जिसका अर्थ है कि प्रत्येक नई बनी DNA डबल हेलिक्स में एक पुरानी और एक नई श्रृंखला होती है।
Q5. DNA प्रतिकृति के चरण कौन-कौन से हैं?
i. आरंभ (Initiation): हेलिकेज़ (Helicase) एंजाइम DNA को खोलता है।
ii. विस्तार (Elongation): DNA Polymerase नए न्यूक्लियोटाइड्स जोड़ता है।
iii. समाप्ति (Termination): प्रतिकृति पूरी होती है और DNA डबल हेलिक्स बनता है।
Q6. प्रमुख और पिछलग्गू श्रृंखला (Leading & Lagging Strand) में अंतर क्या है?
i. प्रमुख श्रृंखला (Leading strand): लगातार (continuously) बनती है।
ii. पिछलग्गू श्रृंखला (Lagging strand): टुकड़ों में बनती है जिन्हें ओकाज़ाकी टुकड़े (Okazaki fragments) कहते हैं।
Q7. RNA प्राइमर का क्या कार्य है?
RNA प्राइमर एक छोटी RNA श्रृंखला होती है जो DNA Polymerase को प्रतिकृति शुरू करने के लिए एक प्रारंभिक बिंदु प्रदान करती है।
Q8. DNA प्रतिकृति की दिशा क्या होती है?
DNA प्रतिकृति 5’ से 3’ दिशा में होती है।
Q9. DNA प्रतिकृति में त्रुटि सुधार कैसे होता है?
DNA Polymerase स्वयं-प्रूफरीडिंग (self-proofreading) क्षमता रखता है जिससे वह गलत न्यूक्लियोटाइड को पहचान कर उसे ठीक कर सकता है।
Q10. DNA प्रतिकृति में कौन-कौन से एंजाइम भाग लेते हैं?
i. Helicase: DNA को खोलता है।
ii. Primase: RNA प्राइमर बनाता है।
iii.DNA Polymerase: न्यूक्लियोटाइड्स जोड़ता है।
iv.Ligase: ओकाज़ाकी टुकड़ों को जोड़ता है।
v. Topoisomerase: तनाव को कम करता है।